
1.如表给出了氯化钠和碳酸钠在不同温度时的溶解度,根据此表推断合理的是( )
|
温度/℃ |
10 |
20 |
30 |
40 | |
|
溶解度/g |
氯化钠 |
35.8 |
36.0 |
36.3 |
36.6 |
|
碳酸钠 |
12.2 |
21.8 |
39.7 |
49.6 | |
A.20℃时,将100g水加入30g碳酸钠中,充分搅拌后得到不饱和溶液
B.20℃时,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为30%
C.两物质的溶解度曲线在20℃﹣30℃之间应出现交点
D.可以采用降温结晶的方法从二者的混合物中提纯氯化钠
【解答】解:A、20℃时,碳酸钠的溶解度为21.8g,将100g水加入30g碳酸钠中将会有部分碳酸钠不能溶解,得到的是饱和溶液,故错误;
B、20℃时,氯化钠的溶解度为36g,将100g水加入30g氯化钠中,充分搅拌后所得溶液中溶质质量分数为:30g/(100g+30g)×100%=23.1%,故错误;
C、根据两物质的溶解度曲线变化趋势可以看出在20℃﹣30℃之间两曲线应出现交点,故正确;
D、碳酸钠的溶解度受温度的影响变化大,氯化钠的溶解度受温度影响不大,所以碳酸钠溶液中混有少量的氯化钠,可通过降温结晶(或冷却热的饱和溶液)的方法提纯;而氯化钠溶液中混有少量的碳酸钠,可通过蒸发结晶的方法提纯,故错误;
故选C.
2.10℃时,50g水里最多溶解甲物质10g,20℃时100g水里最多溶解乙物质20g,则甲、乙两物质的溶解度为( )
A.甲>乙 B.甲=乙 C.甲<乙 D.无法比较
【解答】解:溶解度的大小与温度有关,因为甲乙两种物质所处的温度不同,所以溶解度是无法比较的,
故选D
3.在不同温度下,将一定量的NaCl和KNO3分别加入100g水中,实验情况记录于下表中,有关结论正确的是( )
|
序号 |
温度 |
溶解情况 | |
|
实验1 |
20℃ |
最多溶解36g NaCl |
最多溶解31.6g KNO3 |
|
实验2 |
40℃ |
加入36g NaCl全部溶解 |
加入31.6g KNO3全部溶解 |
|
实验3 |
80℃ |
最多溶解38.4g NaCl |
最多溶解169g KNO3 |
A.KNO3的溶解能力一定大于NaCl
B.40℃时NaCl的溶解度一定大于KNO3的溶解度
C.将实验3所得溶液分别降温至20℃后,两溶液中溶质的质量:NaCl
D.将实验2所得溶液分别升温至80℃后,溶液的浓度:NaCl>KNO3
【解答】解:A、由实验情况记录表可知,20℃,100g水中最多溶解36gNaCl,而最多溶解31.6gKNO3,则20℃,KNO3的溶解能力一定小于于NaCl,故选项说法错误.
B、40℃,100g水中加入36gNaCl全部溶解,加入31.6gKNO3也全部溶解,但由于不知溶液是否饱和,无法比较NaCl与KNO3的溶解度大小,故选项说法错误.
C、20℃,100g水中最多溶解36gNaCl,而最多溶解31.6gKNO3,即20℃,氯化钠的溶解度大于硝酸钾的溶解度,则将实验3所得溶液分别降温至20℃后,两溶液中溶质的质量NaCl>KNO3,故选项说法错误.
D、80℃100g水中最多溶解38.4gNaCl,最多溶解169gKNO3;实验2所得溶液即40℃100g水中加入36gNaCl全部溶解、加入31.6gKNO3全部溶解形成的溶液,将实验2所得溶液分别升温至80℃后,由于溶液的组成未发生改变,则溶液的浓度NaCl>KNO3,故选项说法正确.
故选D.
4.已知下列现象和数据都是在20℃时所得.
①取110g NH4Cl饱和溶液蒸发掉10g水后,析出晶体3.72g;
②将120g NaNO3饱和溶液和50g NaNO3晶体共置于一个烧杯中,再加入50g水,溶液仍然饱和,还剩余6g晶体没有溶解;
③NaCl饱和溶液中溶质与溶液的质量比为36:136.
则20℃时3种物质的溶解度由大到小的顺序为( )
A.①②③ B.②①③ C.③①② D.①③②
【解答】解:①从“取110g 20℃时的NH4Cl饱和溶液蒸发掉10g水后,析出晶体3.72g”即知,此温度时100g水最多溶解37.2gNH4Cl;
②此题说明在20℃时(50g﹣6g)NaNO3晶体溶解在50g水里溶液恰好饱和;故在20℃100g水里最多溶解88gNaNO3晶体;
③在20℃时NaCl饱和溶液中溶质与溶液的质量比为36:136,所以在20℃时NaCl饱和溶液中溶质与溶剂的质量比为36:100.因而20℃时3种物质的溶解度由大到小的顺序为:②①③.
故选B.
5.向20℃的饱和澄清石灰水中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
A.溶液温度未冷却到20℃时,一定是饱和溶液
B.溶液温度未冷却到20℃时,溶质质量分数比原溶液大
C.溶液温度恢复到20℃时,溶液质量比原溶液小
D.溶液温度恢复到20℃时,溶质质量分数和原溶液的相等
【解答】解:A、氢氧化钙的溶解度随温度的升高而减小,氧化钙与水反应放热,使温度升高,氢氧化钙的溶解度减小,故A正确;
B、溶液温度末冷却到20℃时,氢氧化钙的溶解度小于20℃的溶解度,故溶质质量分数比甲溶液小,故B错误;
C、氧化钙能与水反应生成氢氧化钙,消耗了饱和溶液中的溶剂,使部分氢氧化钙析出,导致溶液质量减小,故C正确;
D、溶液温度恢复到20℃时,仍为氢氧化钙的饱和溶液,同温下同种溶质在同种溶剂中的饱和溶液溶质质量分数相同,故D正确,
故选:B.
6.如图是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是( )
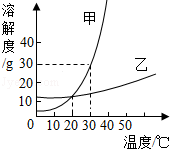
A.甲的溶解度大于乙的溶解度
B.30℃时,甲的饱和溶液中溶质的质量分数为30%
C.乙物质的溶解度受温度变化的影响较小,甲物质的溶解度受温度变化的影响较大
D.甲中含有少量乙时,用蒸发溶剂的方法提纯甲
【解答】解:A、比较溶解度应说明温度,不说明温度比较无意义,故此选项错误.
B、该温度下物质的溶解度30g,所以该温度下溶质的质量分数=30/130×100%=23%,故此选项错误.
C、溶解度随温度变化情况可知,甲的曲线走势明显,而乙不明显,故此选项正确.
D、由于甲的溶解度随温度的升高而明显增大,而乙的溶解度受温度的影响很小,因此可以通过降温结晶的方法来提纯混有乙的甲,故此选项错误.
故选C
7.a、b两种物质的溶解度曲线如图所示,下列说法不正确的是( )
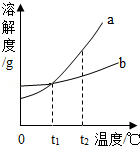
A.要使接近饱和的b溶液转化为饱和溶液,可采用蒸发溶液的方法
B.t2℃时,两种物质的饱和溶液中溶质质量分数a>b
C.将t2℃时a的饱和溶液降温至t1℃,溶液质量不变
D.将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等
【解答】解:A、通过分析溶解度曲线可知,要使接近饱和的b溶液转化为饱和溶液,可采用蒸发溶剂的方法,故A正确;
B、t2℃时,a物质的溶解度大于b物质的溶解度,所以两种物质的饱和溶液中溶质质量分数a>b,故B正确;
C、降低温度,a物质的溶解度减小,所以将t2℃时a的饱和溶液降温至t1℃,溶液质量减小,故C错误;
D、t1℃时,a、b物质的溶解度相等,所以将t2℃时a、b的饱和溶液分别降温至t1℃,两溶液的溶质质量分数相等,故D正确.
故选:C.
8.图是A、B、C三种固体物质的溶解度曲线.下列说法正确的是( )
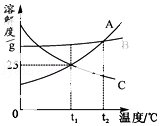
A.t1℃时,A的饱和溶液中溶质质量分数为25%
B.t2℃时,A、B、C三种物质的饱和溶液降温到t1℃所得溶液中溶质质量分数的关系为B>C=A
C.将t1℃时A、C的饱和溶液升温到t2℃时,A、C两溶液都会变成不饱和溶液
D.将t2℃时A、B、C等质量的饱和溶液降温到t1℃时,析出溶质质量最多是A
【解答】解:A、t1℃时,A物质的溶解度是25g,所以A的饱和溶液中溶质质量分数为:25/(100+25)×100%=20%,故A错误;
B、t1℃时,B物质的溶解度最大,A物质的溶解度次之,降低温度,A、B会析出晶体,C物质不会析出晶体,所以t2℃时,A、B、C三种物质的饱和溶液降温到t1℃所得溶液中溶质质量分数的关系为B>A>C,故B错误;
C、试管温度,C物质的溶解度减小,所以将t1℃时A、C的饱和溶液升温到t2℃时,C物质都会变成不饱和溶液,故C错误;
D、A物质的溶解度受温度变化影响较大,所以将t2℃时A、B、C等质量的饱和溶液降温到t1℃时,析出溶质质量最多是A,故D正确.
故选:D.
9.图是甲、乙、丙三种固体物质的溶解度曲线.下列叙述错误的是( )
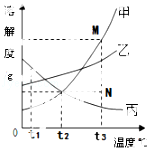
A.t2℃时,三种物质的溶解度大小顺序为:乙>甲=丙
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.采用降低温度的方法,可将饱和的丙物质溶液变成不饱和
【解答】解:A、由溶解度曲线可知:t2℃时,三种物质的溶解度大小顺序为:乙>甲=丙正确,正确但不符合题意,故选项错误;
B、t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等错误,因为没有指明是饱和溶液,错误符合题意,故选项正确;
C、若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲,因为甲受温度的影响变化比较大,正确但不符合题意,故选项错误;
D、采用降低温度的方法,可将饱和的丙物质溶液变成不饱和,因为丙的溶解度随温度的升高而减少,正确但不符合题意,故选项错误;
故选B
10.如图表示甲、乙、丙三种物质的溶解度曲线,下列说法正确的是( )
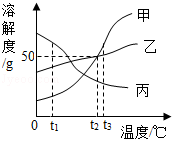
A.t2℃时,甲、乙溶液中溶质质量分数一定相等
B.乙中含有少量甲,可采用降温结晶的方法提纯乙
C.t3℃时,甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数的大小关系为乙>丙>甲
D.t2℃时,100g甲的饱和溶液中加入400g水,得到10%的甲溶液
【解答】解:A、不知溶液中溶质、溶剂的质量多少,无法判断溶质的质量分数是否相等;据饱和时质量分数的计算式:溶解度/(100g+溶解度)×100%可知:若两溶液是饱和溶液,该温度下二者的溶解度相等,则溶质的质量分数相等;故错误;
B、乙的溶解度随温度的变化不大,乙中含有少量甲,可采用蒸发结晶的方法提纯乙,故错误;
C、将t3℃时等质量的甲、乙、丙三种物质的饱和溶液同时降温到t1℃,丙的溶质质量分数不变,甲和乙的都有晶体析出,溶质质量分数会减小,根据图象可以看出,在t1℃时甲、乙、丙三种物质的溶解度是乙>丙>甲,三种物质的饱和溶液中溶质质量分数的大小关系是乙>丙>甲,故正确;
D、t2℃时,100g甲的饱和溶液中所含溶质的质量=50*100/150≈33g,加入400g水,所得溶液中溶质质量分数=33/(100+400)×100%≈6.7%,无法得到10%的甲溶液,故错误.
答案:C
11.如图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是 )
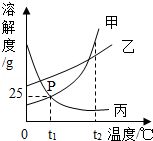
A.P点表示甲、丙两种物质的饱和溶液质量相等
B.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液
C.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4
D.将三种物质的溶液从t2℃降至t1℃,析出晶体最多的是甲物质
【解答】解:A、P点表示甲、丙两种物质的饱和溶液的溶质质量分数相等,故A错误;
B、乙物质的溶解度随温度的升高而增大,所以t1℃时,乙物质的饱和溶液,升温至t2℃时会变成不饱和溶液,故B错误;
C、t1℃时,甲物质的溶解度是25g,所以甲物质的饱和溶液中溶质和溶剂的质量比为25g:100g=1:4,故C正确;
D、将三种物质的溶液质量不能确定,所以从t2℃降至t1℃,析出晶体的多少不能确定,故D错误.
故选:C.
12.如图是甲、乙的溶解度曲线,下列说法不正确的是( )
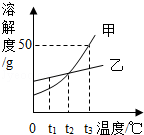
A.t1℃时,乙的溶解度大于甲的溶解度
B.t2℃时,甲、乙饱和溶液中溶质质量分数相等
C.降低温度能使接近饱和的甲溶液变为饱和溶液
D.t3℃时,75g甲的饱和溶液中加入50g水,可以得到质量分数为25%的溶液
【解答】解:A、由图可知:t1℃时,乙的溶解度大于甲的溶解度,正确;
B、t2℃时,甲、乙的溶解度曲线交于一点,溶解度相等,则饱和溶液中溶质质量分数相等,正确;
C、甲的溶解度随温度降低而减小,所以降温可使其不饱和溶液变为饱和溶液,正确;
D、t3℃时甲的溶解度是50g,即100g水中最多溶解50g甲,形成饱和溶液150g,则75g甲的饱和溶液中有25g甲,加50g水得到溶液的质量分数=25/125×100%=20%,而非25%,故错误;
故选:D.
13.如图是甲、乙、丙三种物质的溶解度曲线,下列说法中正确的是( )
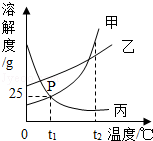
A.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1:4
B.P点表示甲、丙两种物质的饱和溶液质量相等
C.t1℃时,乙物质的饱和溶液,升温至t2℃时仍是饱和溶液
D.将三种物质的溶液从t2℃降至t1℃,析出晶体最多的是甲物质
【解答】解:A、t1℃时,甲物质的溶解度是25g,所以甲物质的饱和溶液中溶质和溶剂的质量比为25g:100g=1:4,故A正确;
B、P点表示甲、丙两种物质的饱和溶液质量的质量分数相等,故B错误;
C、乙物质的溶解度随温度的升高而增大,所以t1℃时,乙物质的饱和溶液,升温至t2℃时不是饱和溶液,故C错误;
D、三种物质饱和溶液的质量不能确定,所以将三种物质的溶液从t2℃降至t1℃,析出晶体的质量不能确定,故D错误.
故选:A.
14.如图为甲、乙两物质的溶解度曲线,下列说法正确的是( )

A.甲、乙两物质均属于难溶物质
B.甲物质的溶解度大于乙物质的溶解度
C.t1℃时,甲、乙两物质饱和溶液的溶质质量分数相等
D.t2℃时,甲物质饱和溶液的溶质质量分数为50%
【解答】解:A、通过分析溶解度曲线可知,在10℃时,甲、乙物质的溶解度大于10g,所以甲、乙两物质均属于易溶物质,故A错误;
B、在比较物质的溶解度时,需要指明温度,故B错误;
C、t1℃时,甲、乙两物质的溶解度相等,所以饱和溶液的溶质质量分数相等,故C正确;
D、t2℃时,甲物质的溶解度是50g,所以甲物质饱和溶液的溶质质量分数为50/150×100%=33.3%,故D错误.
故选:C.
15.打开汽水瓶盖,有大量气体的泡沫逸出,下列说法不正确的是( )
A.溶质减少 B.溶解度减小
C.浓度减小 D.饱和溶液变成不饱和溶液
【解答】解:气体的溶解度随着压强的增大而增大,随着压强的减小而减小.打开汽水瓶盖时,压强减小,原来溶解的二氧化碳气体的溶解度减小,一部分二氧化碳逸出,溶液中溶质、浓度减小,逸出后的二氧化碳溶液仍然是饱和溶液.所以,A、B、C正确,D错误.
故选D.
 ,我们将会及时处理。
,我们将会及时处理。