
1.二氧化硫气体是造成酸雨的主要物质.为了探究二氧化硫能与水反应生成具有酸性的物质,四位同学设计了如下一组实验:取几朵用石蕊试液染成紫色的干燥的纸花,按下图进行实验,观察纸花颜色的变化.下列有关的说法,你认为正确的是()
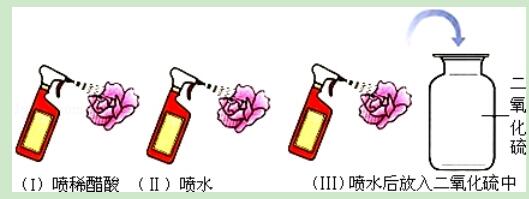
A.小雨同学认为:实验Ⅰ中喷稀醋酸紫色小花变红,是为了证明酸性物质使紫色石蕊试液变红色
B.小军同学认为:实验Ⅱ喷水是多余的
C.小涛同学认为,若实验Ⅲ中的紫色小花变红,则证明假设成立
D.小芳同学对实验方案提出了质疑,她认为还需补充一个实验才能使探究活动获得成功
【解答】解:A、实验Ⅰ中喷稀醋酸紫色小花变红,是为了证明酸性物质使紫色石蕊试液变红色,正确;
B、实验Ⅱ喷水是为了证明水不能使石蕊试液变色,不是多余的,错误;
C、实验Ⅲ中的紫色小花变红,不能说明是反应生成的酸使石蕊试液变色,因为没有设计实验证明二氧化硫不能使石蕊变色,错误;
D、还需补充一个实验证明二氧化硫不能使石蕊变色,才能使探究活动获得成功,正确;
故选AD.
2.某同学要完成纯净的氨气与灼热的氧化铜的反应(2NH3+3CuO=3Cu+3H2O+N2),图中(夹持、固定装置均略去)仪器连接顺序最合适的是( )
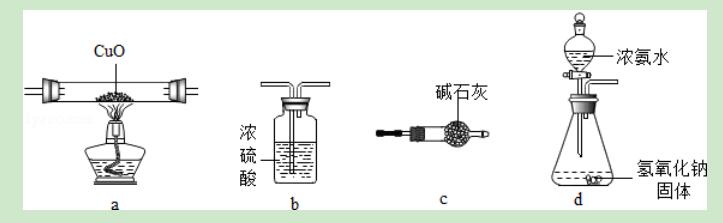
A.dabc B.dcab C.dbac D.dacb
【解答】解:先制备氨气,然后用碱石灰对氨气进行干燥,再将氨气通过加热的氧化铜,最后将没有参加反应的氨气用浓硫酸来吸收.
故选B.
3.通过下列实验得出的结论不合理的是( )
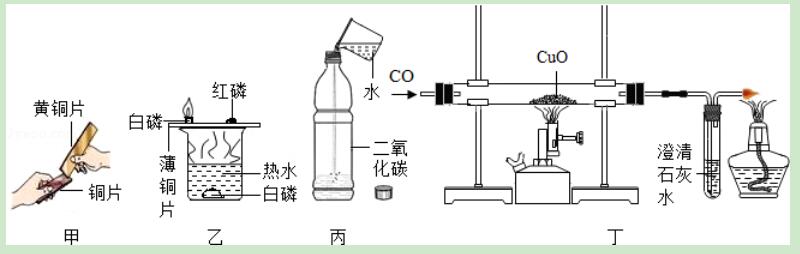
A.甲图黄铜片能在铜片上刻出明显痕迹,说明黄铜片的硬度比铜大
B.乙图薄铜片上的白磷燃烧,红磷和水中的白磷不燃烧,说明燃烧既要有氧气参加,温度又要达到可燃物的着火点
C.丙图既可以说明二氧化碳易溶于水,又可以说明它能与水反应生成碳酸
D.丁图说明一氧化碳具有还原性
【解答】解:A、合金的性质是合金的硬度大,熔点低,耐腐蚀,故选项正确;
B、燃烧的条件是:既要有氧气参加,温度又要达到可燃物的着火点,故选项正确;
C、丙图可以说明二氧化碳能溶于水,不是易溶于水,也不能说明它能与水反应生成碳酸;故选项错误;
D、一氧化碳和氧化铜反应生成铜和二氧化碳,说明一氧化碳具有还原性,故选项正确;
故选C
4.小婷同学想用实验证明高锰酸钾溶液的紫红色是MnO4﹣离子的颜色,而不是K+离子的颜色,他设计的下列实验事实与证明该问题无关( )
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾、硝酸钾、硫酸钾溶液都没有颜色,表明溶液中K+离子无色
C.向氯化钾溶液中加入过量锌粉,振荡,静置后未见明显变化,表明锌与K+离子不反应
D.向高锰酸钾溶液中加入过量锌粉,振荡,静置后见紫红色褪去,表明MnO4﹣离子呈紫红色
【解答】解:A、加热高锰酸钾固体,质量减少,没有体现高锰酸根在溶液中的情况,故A没有意义.
B、氯化钾、硝酸钾、硫酸钾溶液中有K+,但没有颜色,故表明溶液中K+无色,故B有意义.
C.D、C的目的是为D创造条件,C中说明锌与K+不反应,D中加入锌粉褪色,说明不是K+作用,运用了排除法.故CD都有意义.
故选A.
5.某同学设计了右图所示的装置探究铁锈蚀的条件.a管中装入少量煮沸的蒸馏水,b管中是干燥的空气.调节L端与R端的液面高度一致,塞紧木塞.一段时间后观察.下列推断错误的是( )
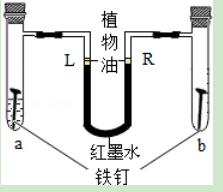
A.只有a管中的铁钉会锈蚀
B.L端与R端的液面高度仍然保持一致
C.该实验说明铁的锈蚀与空气和水有关
D.常温下b管中的铁钉很难锈蚀
【解答】解:
A、只有a管中的铁钉会锈蚀.b管中是干燥的空气,铁在干燥的空气中很难生锈.故A正确
B、L端与R端的液面高度仍然保持一致 铁在空气中生锈,主要是铁跟水和氧气等物质反应,a管中有水反应速度应快些,气压相对低了,红墨水的水平就升高了.故B错误
C、该实验说明铁的锈蚀与空气和水有关 实验结果是L端红墨水上升了,说明a管中铁生锈快,证明铁的生锈与水和空气有关.故C正确
D、常温下b管中的铁钉很难锈蚀 铁在干燥的空气中很难锈蚀,故D正确的.
故选B.
6.用如图装置完成以下试验:
(1)探究燃烧条件:若B处盛放木炭.
Ⅰ.先在A处通入氮气一段时间后,在B处加热,B、C处没有明显变化;
Ⅱ.待B处冷却至室温,在A处通入氧气一段时间后,B、C处没有明显变化;
Ⅲ.在A处继续通入氧气,然后在B处加热,发现木炭燃烧,C处变浑浊.
(2)模拟工业炼铁:若B处盛放氧化铁粉末.在A处通入一氧化碳一段时间后,B处下方用酒精喷灯加热.下列说法中正确的是( )
①Ⅰ和Ⅲ对比,说明燃烧需要可燃物与氧气接触
②Ⅰ和Ⅲ对比,说明O2的化学性质比氮气活泼
③Ⅱ与Ⅲ对比,说明燃烧需要温度超过可燃物的着火点
④该实验还能证明燃烧需要可燃物
⑤实验(2)中缺乏尾气处理装置
⑥实验(2)中玻璃管内物质的质量在反应前后的减少量可能等于C中反应前后物质的质量的增加量.
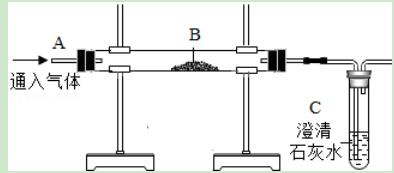
A.①②③④⑤⑥ B.①②③④⑤ C.①②⑤⑥ D.①②⑤
【解答】解:①Ⅰ与Ⅲ对比,通入的气体不同,温度相同,由Ⅲ中木炭能燃烧Ⅰ中木炭不燃烧说明燃烧需要可燃物与氧气接触,故①正确;
②Ⅰ和Ⅲ对比,氧气能与木炭反应氮气不能与木炭反应,说明O2的化学性质比氮气活泼,故②正确;
③Ⅱ与Ⅲ对比,说明燃烧需要温度达到可燃物的着火点,不是超过可燃物的着火点,故③错误;
④该实验不能证明燃烧需要可燃物,故④错误;
⑤实验(2)中的尾气中含有一氧化碳,能污染空气,该装置缺乏尾气处理装置,故⑤正确;
⑥实验(2)中玻璃管内物质的质量在反应前后的减少量是氧元素的质量,C中反应前后物质的质量的增加量是二氧化碳的质量,二者不可能相等.故⑥错误.
由以上分析可知,D正确.
故选D.
7.如图是一组用于研究可燃物燃烧条件的对比实验,对有关实验现象和结论的判断错误的是( )
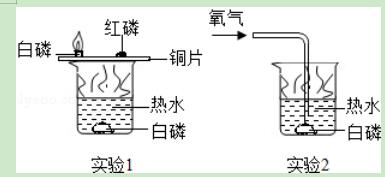
A.实验1中红磷未燃烧,说明红磷的着火点高于白磷
B.实验2中白磷燃烧,说明实验2中的热水温度高于实验1
C.实验2中如果停止通入氧气,燃着的白磷会熄灭
D.可燃物燃烧需要氧气(或空气),并达到着火点
【解答】解:铜片上的红磷和白磷所处环境一样,只能说明是温度达不到的原因,即说明红磷的着火点高.实验2中温度并没有变化,只是提供氧气,即能燃烧,说明是与氧气有关,同样如果撤了氧气,白磷就不能燃烧.由此可以得出燃烧的条件是:可燃物、与氧气接触、达到着火点.故选择B
8.下列做法中,能减缓化学反应速率的是( )
A.面团发酵时放在温热处 B.人在进食时细细嚼食物
C.将食品放入冰箱冷藏 D.煤燃烧时向煤炉中鼓入空气
【解答】解:A、面团发酵时放在温热处,温度升高,物质反应的速率加快,故选项错误.
B、人在进食时细细嚼食物,能增大反应物的接触面积,能加快反应的速率,故选项错误.
C、将食品放入冰箱冷藏,冰箱中温度低,可以延缓食品的发生缓慢氧化的速率,故选项正确.
D、煤燃烧时向煤炉中鼓入空气,增大了反应物的接触面积,加快反应的速率,故选项错误.
故选:C.
9.实验表明:不能用块状的大理石与稀硫酸反应制取二氧化碳,而用大理石的粉末可以和稀硫酸反应制取二氧化碳.由此可以得出的结论与上述事实相符合的是( )
A.发生反应的物质间能否发生反应,与反应条件有关
B.反应物之间接触面积越大,越有利于反应的进行
C.块状的大理石和粉末状的大理石,化学性质不同
D.块状的大理石和粉末状的大理石中,各元素原子的排列不同
【解答】解:不能用块状的大理石与稀硫酸反应制取二氧化碳,而用大理石的粉末可以和稀硫酸反应制取二氧化碳,大理石的粉末与块状的大理石相比较,大理石的粉末与稀硫酸的接触面积更大,反应物之间接触面积越大,越有利于反应的进行.
故选:B.
10.多数食品易吸收空气中的水分变潮,并与空气中的O2反应腐败.生产上多在食品上放入一包CaO粉未,使食品保持干燥.现已研究成功在食品中放入一包铁粉(包裹在多孔泡沫中)铁粉吸收水分和氧气变成铁锈,从而保护食品.下列说法不正确的( )
A.两干燥剂袋上都要有明显的“勿食”字样
B.生成铁锈的主要成分是氧化铁
C.铁粉干燥剂能与水和O2 发生化学反应
D.CaO干燥剂保护食品的效果比铁粉干燥剂好
【解答】解:A、氧化钙具有腐蚀性,铁粉不能食用,两种干燥剂袋上都要有明显的“勿食”字样,故选项说法正确.
B、生成铁锈的主要成分是氧化铁,故选项说法正确.
C、铁粉干燥剂能与水和O2发生化学反应,故选项说法正确.
D、铁生锈需要有氧气和水共同存在,在食品包装中加入铁粉不仅能吸水,还能除去氧气,其干燥效果比氧化钙好,故选项说法错误.
故选:D.
11.实验室利用H2+CuO=Cu+H2O反应原理(实验装置见图),测定水分子中氢氧原子的“相对原子质量”比值,实验室中制得的氢气中有少量水蒸气.则有关实验操作说法正确的是( )
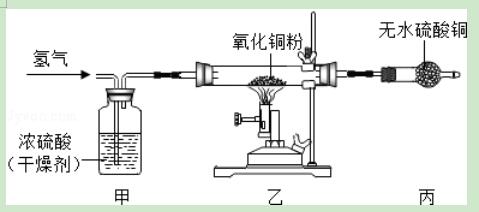
A.只需要获得氧化铜粉前后的质量差
B.只需要获得无水硫酸铜前后的质量差
C.若没有“甲”装置,所得比值偏大
D.实验中一定要通入足量的氢气将氧化铜完全反应
【解答】解:
A、只能测出反应的氧化铜中的氧元素的质量,故错;
B、只能测出生成的水的质量,故错;
C、如果没有干燥剂 那么无水硫酸铜质量增加测得比值偏大,故对;
D、不一定,因为实验要求测量的是比值是否完全反应是不影响的,故错.
答案:C.
12.工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4.为了测定铁红中铁的质量分数,兴趣小组的同学利用草酸晶体(H2C2O4•3H2O)分解产生的气体产物进行了如下的实验,请你参与过程分析.
【资料】草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4•3H2O
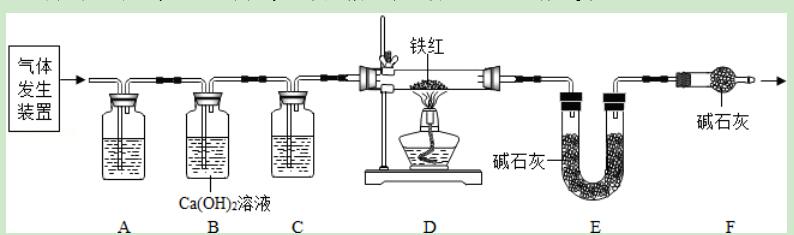
关于该实验有下列说法:
①用草酸晶体制取一氧化碳气体的发生装置与双氧水制取氧气的装置不相同
②进入D中的气体是纯净、干燥的CO.则A、C中的试剂依次是澄清石灰水和浓硫酸
③对D装置加热前和停止加热后.都要通入过量的CO,其作用是防止爆炸
④装置F的作用是防止空气中的二氧化碳和水蒸气进入到E装置中
⑤若没有装置F,则测定的铁元素的质量分数会偏大
⑥若没有C装置,则测定的铁元素的质量分数会偏小
以上说法正确的是( )
A.①④⑥ B.①④⑤ C.①②④⑤ D.①②④⑥
【解答】解:①用草酸晶体制取一氧化碳气体需要加热,而利用过氧化氢制取氧气不需要加热,因此用草酸晶体制取一氧化碳气体的发生装置与双氧水制取氧气的装置不相同,该选项说法正确;
②进入D中的气体是纯净、干燥的CO.则A、C中的试剂依次浓氢氧化钠溶液和浓硫酸,利用浓氢氧化钠溶液可以吸收二氧化碳气体,利用浓硫酸可以干燥一氧化碳,B中的澄清石灰水用来检验二氧化碳气体是否被氢氧化钠溶液完全吸收,氢氧化钙微溶于水,该实验中通常不用于吸收二氧化碳气体,该选项说法不正确;
③对D装置加热前和停止加热后.都要通入过量的CO,加热前通入一氧化碳是为了防止爆炸,停止加热后继续通入一氧化碳是为了防止铁被氧气氧化,该选项说法不正确;
④装置F的作用是防止空气中的二氧化碳和水蒸气进入到E装置中,该选项说法正确;
⑤若没有装置F,空气中的水蒸气和二氧化碳会进入E装置中,导致测定的二氧化碳质量偏大,从而导致则测定的铁元素的质量分数会偏小,该选项说法不正确;
⑥若没有C装置,会导致水蒸气进入E装置中,导致测定的二氧化碳质量偏大,从而导致测定的铁元素的质量分数会偏小,该选项说法正确.
故选:A.
13.4月30日晚,上海世博会开幕式上匠心独具的焰火表演,营造了如诗如画的“春江花月夜”氛围.有关烟花、爆竹成分的推测不合理的是( )
A.燃放烟花时,发出蓝紫色火焰,说明烟花中可能含有铁粉
B.燃放烟花时,发出耀眼的白光,说明烟花中可能含有镁粉
C.鞭炮的火药呈黑色,说明鞭炮中可能有木炭粉
D.鞭炮爆炸后,产生有刺激性气味的气体,说明鞭炮中可能含有硫粉
【解答】解:铁粉在空气中不能燃烧,只能受热变成红热状态,不可能出现蓝紫色火焰,故A错误;
B、镁在空气中燃烧发出明亮的白光,燃放烟花时,发出耀眼的白光,说明烟花中可能含有镁粉,故B正确;
C、木炭粉是黑色的,鞭炮的火药呈黑色,说明鞭炮中可能有木炭粉,故C正确;
D、硫燃烧生成有刺激性气味的二氧化硫,鞭炮爆炸后,产生有刺激性气味的气体,说明鞭炮中可能含有硫粉,故D正确;
故选A.
14.用如图装置(图中夹持仪器已略去)测定某牙膏样品中碳酸钙的质量分数.实验中,通过测定丙装置质量的改变值,就能达到目的(样品中其他成分遇盐酸不产生气体).下列措施能提高测定准确度的是( )
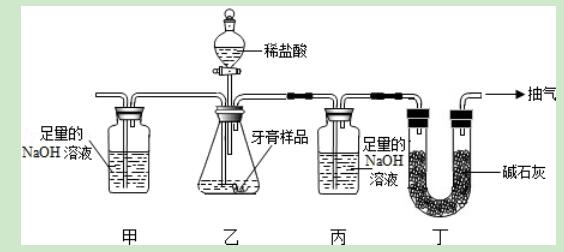
A.省去装置甲和丁
B.将丙中的NaOH溶液换成Ca(OH)2溶液
C.装置乙不再产生气泡时,立即停止抽气
D.滴加稀盐酸之前,先抽气一段时间,除去装置内原有的CO2
【解答】解:A、省去装置甲和丁时,装置内和装置外的二氧化碳会被氢氧化钠溶液吸收,能降低测定准确度.
B、将丙中的NaOH溶液换成Ca(OH)2溶液时,不利于二氧化碳的完全吸收,能降低测定准确度.
C、装置乙不再产生气泡时,立即停止抽气,生成的二氧化碳不能被完全吸收,能降低测定准确度.
D、滴加稀盐酸之前,先抽气一段时间,除去装置内原有的二氧化碳,可以提高测定准确度.
故选:D.
15.过氧化镁(MgO2)易溶于稀酸,溶于酸后产生H2O2.过氧化镁产品中常会混有少量MgO,实验室测定样品中过氧化镁的含量装置如图所示.下列说法错误的是( )
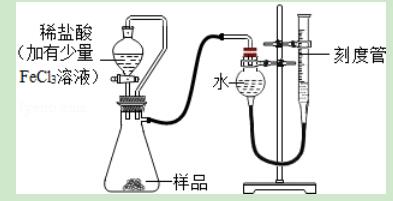
A.稀盐酸中加少量FeCl3溶液的作用可能是作为H2O2分解的催化剂
B.分液漏斗与锥形瓶间的橡胶管只有使液体顺利下滴的作用
C.实验结束,需冷却并将刻度管缓缓下移至两侧液面相平再读数
D.该测定还需要的数据是样品质量和此温度和压强下氧气的密度
【解答】解:A、稀盐酸中的FeCl3主要作用是使产生的过氧化氢全部分解放出气体,以便被测量,说法正确;
B、分液漏斗与锥形瓶间的橡胶管一方面是使液体顺利下滴,另一方面是保持瓶内气压稳定,故错误;
C、实验结束,需冷却并将刻度管缓缓下移至两侧液面相平再读数,防止气体的热胀冷缩对体积造成的影响,正确;
D、测定样品中过氧化镁的含量思路是:据质量=密度×体积计算出氧气的质量,计算出过氧化镁的质量,再用过氧化镁的质量除以样品的质量即可,所以还需要测定样品质量和压强下氧气的密度,正确;
故选B.
 ,我们将会及时处理。
,我们将会及时处理。