
1.将某盐酸与氢氧化钠溶液混合后,向其中滴加紫色石蕊试液,溶液变红,下列说法不正确的是( )
A.混合后溶液的pH<7
B.混合后溶液为氯化钠溶液
C.混合后溶液的质量是混合前两种溶液的质量之和
D.混合后溶液中水的质量大于混合前两种溶液中水的质量之和
【解答】解:A、混合后溶液的pH<7,说明溶液呈酸性,能使石蕊变红,故A正确;
B、混合后溶液为氯化钠溶液,则溶液呈中性,石蕊为紫色,不会变红,故B错误;
C、根据质量守恒定律,反应前后物质的总质量不变,所以混合后溶液的质量是混合前两种溶液的质量之和,故C正确;
D、盐酸和氢氧化钠反应后生成水,所以混合后溶液中水的质量大于混合前两种溶液中水的质量之和,故D正确,
故选B.
2.某同学用洁净干燥的玻璃棒蘸取盐酸滴在湿润的pH试纸上,测得pH=3,他判断这是一种酸性溶液,对他的操作方法、测量结果及结论的评价,正确的是( )
A.方法正确,测量结果正确,结论正确
B.方法错误,测量结果偏小,结论正确
C.方法错误,测量结果偏大,结论错误
D.方法错误,测量结果偏大,结论正确
【解答】解:用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH,某同学用洁净干燥的玻璃棒蘸取盐酸滴在湿润的pH试纸上,稀释了待测溶液,当溶液的pH小于7时,呈酸性,且pH越小,酸性越强,则使溶液的酸性减弱,测定结果偏大,但结论正确.
A、方法错误,测量结果偏大,结论正确,故选项错误.
B、方法错误,测量结果偏大,结论正确,故选项错误.
C、方法错误,测量结果偏大,结论正确,故选项错误.
D、方法错误,测量结果偏大,结论正确,故选项正确.
故选:D.
3.某固体可能含有Ca(NO3)2、Na2SO4、Na2CO3、FeCl3、KCl中的一种或几种,现对其进行如下实验:①取少量固体于试管中,加适量蒸馏水,固体完全溶解成无色透明溶液②取少量上述溶液,加过量稀硫酸,有气泡产生③取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀.分析以上实验现象,对原固体组成的推断正确的是( )
A.肯定有Na2CO3、Na2SO4,无FeCl3、Ca(NO3)2
B.肯定有Na2CO3,无FeCl3、Ca(NO3)2
C.肯定有Na2CO3、Na2SO4,无FeCl3
D.肯定有Na2CO3,无FeCl3、KCl
【解答】解:根据步骤①:固体完全溶解成无色透明溶液.因为Ca2+可以与SO42﹣反应生成白色微溶物CaSO4,Ca2+也可以与CO32﹣反应生成白色沉淀CaCO3,所以Ca(NO3)2与Na2SO4、Na2CO3不能共存,又因为FeCl3显浅黄色,所以原固体中无FeCl3;
根据步骤②:取少量上述溶液,加过量稀硫酸,有气泡产生.因为稀硫酸可以与Na2CO3反应生成CO2气体,所以原固体中有Na2CO3,根据①的分析可知无Ca(NO3)2;
根据步骤③:取②所得溶液少量,滴加BaCl2溶液,产生白色沉淀.此处的白色沉淀是BaSO4,但步骤②中所加稀硫酸过量,所以原固体中无法确定有无Na2SO4.
综上所述,原固体中一定有Na2CO3,一定无Ca(NO3)2、FeCl3,不能确定的是Na2SO4、KCl.
故选B
4.近日,深圳曝出居民楼房楼板开裂、墙体裂缝等问题,每逢雨天渗水不断.而根据市政府的调查结果显示,问题的根源就是建设时使用大量海砂.海砂中超标的氯离子将严重腐蚀建筑中的钢筋,使楼体不稳,甚至倒塌.而与海砂相比,河砂则一般不含氯离子.小明想知道楼下的一堆砂子是不是海砂,他应该在下面四种药品中选择哪些来完成实验?( )
①BaCl2②AgNO3③HNO3④HCl.
A.①③ B.②③ C.①④ D.①②
【解答】解:与海砂相比,河砂则一般不含氯离子,故检验楼下的一堆砂子是不是海砂,检验是否含氯离子即可,检验氯离子可选用用硝酸酸化的硝酸银溶液,若产生白色沉淀,说明含有氯离子.
①氯离子不能与BaCl2溶液反应,不能用于检验是否含氯离子.
②氯离子与AgNO3溶液反应生成不溶于硝酸的氯化银白色沉淀,硝酸银溶液和硝酸可用于检验是否含氯离子.
③氯离子与AgNO3溶液反应生成不溶于硝酸的氯化银白色沉淀,硝酸银溶液和硝酸可用于检验是否含氯离子.
④氯离子不能与AgNO3溶液反应生成不溶于硝酸的氯化银白色沉淀,不能使用HCl,否则会引入氯离子,不能确定砂子中是否含有氯离子.
故②③可用于检验是否含氯离子.
故选:B.
5.要证明稀硫酸中含有盐酸所需药品正确的滴加顺序是( )
A.先滴加AgNO3溶液再滴加BaCl2溶液
B.先滴加BaCl2 溶液再滴加AgNO3溶液
C.先滴加Ba(NO3)2 溶液再滴加AgNO3溶液
D.先滴加AgNO3 溶液再滴加Ba(NO3)2溶液
【解答】解:A、先滴加AgNO3溶液,硫酸、盐酸均能与硝酸银溶液反应生成白色沉淀,不能证明稀硫酸中含有盐酸,故选项错误.
B、先滴加BaCl2 溶液,硫酸与氯化钡溶液反应生成硫酸钡沉淀和盐酸,由于生成了盐酸,不能证明原稀硫酸中含有盐酸,故选项错误.
C、先滴加Ba(NO3)2 溶液,硫酸与硝酸钡溶液反应生成硫酸钡沉淀和硝酸,再滴加AgNO3溶液,盐酸与硝酸银溶液反应生成氯化银沉淀和硝酸,能证明稀硫酸中含有盐酸,故选项正确.
D、先滴加AgNO3溶液,硫酸、盐酸均能与硝酸银溶液反应生成白色沉淀,不能证明稀硫酸中含有盐酸,故选项错误.
故选:C.
6.用氯酸钾和二氧化锰混合加热制取氧气,将制得的气体通入蒸馏水中,再向水中滴加含HNO3的AgNO3溶液,结果有白色沉淀产生.根据以上事实,某同学做出如下结论:①制得的氧气不是纯净物;②制得的氧气中混有含氯的物质;③制得的气体中含有氯元素;④在发生氯酸钾分解反应的同时,还发生了其他反应.以上结论正确的是( )
A.只有①③ B.只有①② C.①②③ D.①②③④
【解答】解:将制得的气体通入蒸馏水中,再向水中滴加含HNO3的AgNO3溶液,结果有白色沉淀产生,说明制得的氧气溶于水产生了氯离子,故氧气不是纯净物,含有氯元素,而要生成含氯元素的物质,除了发生氯酸钾分解生成氯化钾和氧气的反应,还发生了其他的反应,所以①②③④都正确,故选D.
7.(2013•汉滨区校级模拟)我省巢湖市的温泉远近闻名.分析鉴定可知,该地区温泉的水中含有较多的硫酸根离子,以及钾、钠、钙、锌、锶等多种对人体有益的微量元素.下列关于硫酸根离子的鉴定方法中,正确的是( )
A.滴加盐酸
B.滴加Ba(NO3)2溶液后,再加稀HNO3
C.滴加NaOH溶液后,再加稀盐酸
D.加Na2CO3溶液后,再加稀HNO3
【解答】解:A、滴加盐酸与硫酸根并无特征变化发生,故A错.
B、鉴定硫酸根的存在一般加入钡盐检验是否生成不溶于硝酸的沉淀,为防止银离子的干扰一般可采用硝酸钡进行检验.故此选项正确.
C、加氢氧化钠与硫酸根也不会有反应,故C错.
D、加碳酸钠时不会与硫酸根发生反应,只会与一些金属离子结合成沉淀,加酸后会溶解,与硫酸根的检验无直接关系,故D错误.
故选B
8.检验碳酸盐的正确方法是( )
A.滴加盐酸,产生使木条火焰熄灭的气体
B.滴加BaCl2溶液产生白色沉淀
C.加热,产生使澄清石灰水变浑浊的气体
D.滴加盐酸产生使澄清石灰水变浑浊的气体
【解答】解:检验碳酸盐常用的方法是滴加盐酸检验是否有使澄清石灰水变混浊的气体产生;
A、因为使木条熄灭的不一定是二氧化碳,故不正确;
B、滴加氯化钡产生白色沉淀的出碳酸盐外还有硫酸盐,故不正确;
C、加热产生二氧化碳的物质不一定只有碳酸盐.
故答案应为:D
9.下列有关物质的检验、鉴别、分离和除杂所用的试剂或方法正确的是( )
|
选项 |
实验目的 |
所用试剂或方法 |
|
A |
检验某白色固体是否为碳酸盐 |
稀盐酸 |
|
B |
鉴别一氧化碳和甲烷两瓶气体 |
燃着的木条 |
|
C |
从H2O2溶液制氧气的残余物中分离出MnO2 |
过滤或蒸发 |
|
D |
除去二氧化碳气体中的水蒸气 |
氢氧化钠固体 |
A.A B.B C.C D.D
【解答】解:A、滴加稀盐酸产生气体的白色固体有可能是碳酸盐和氢前的白色金属,不一定是碳酸盐,故要检验是否是碳酸盐还需要将气体通入澄清的石灰水,观察是否变浑浊,只用稀盐酸无法鉴别;
B、一氧化碳和甲烷都能燃烧,具有可燃性,用燃着的木条点燃都能燃烧,现象相同,无法鉴别;
C、二氧化锰不溶于水,过滤可以得到二氧化锰,或将水蒸发,剩下二氧化锰,正确;
D、二氧化碳可与氢氧化钠反应,若通过氢氧化钠固体,则将二氧化碳和水蒸气同时除去,故不能用氢氧化钠干燥,故错误;
故选C.
10.体操运动员常用一种白色的“镁粉”搓手,去除手上的汗渍,增加掌心与器械的摩擦力.这种“镁粉”溶解性很差,但有很好的吸水性.向“镁粉”中加入适量稀盐酸,立刻产生大量气泡,产生的气体能使澄清石灰水变浑浊,同时得到无色澄清溶液;“镁粉”加入适量水长时间煮沸后,滤出白色固体,加入稀盐酸,固体溶解,但不产生气泡.下列说法正确的是( )
A.该“镁粉”是单质镁
B.可以用生石灰替代“镁粉”除去汗渍
C.“镁粉”加水煮沸后滤出的白色固体是碳酸镁
D.“镁粉”加水煮沸的过程中一定发生了化学变化
【解答】解:A、向“镁粉”中加入适量稀盐酸,立刻产生大量气泡,产生的气体能使澄清石灰水变浑浊,说明该物质中含有碳酸镁,因此该“镁粉”一定不是单质镁,故A错误;
B、生石灰可以吸收水分,但其溶于水放热,且生成的氢氧化钙有腐蚀性,所以不能用生石灰替代“镁粉”除去汗渍,会对手造成伤害,故错误;
C、加入适量水长时间煮沸后,滤出白色固体,加入稀盐酸,固体溶解,但不产生气泡,说明白色固体中不含碳酸根离子,故“镁粉”加水煮沸后滤出的白色固体一定不是碳酸镁,故错误;
D、“镁粉”中含有碳酸镁,但煮沸后的固体中不含碳酸镁,说明煮沸发生了化学变化,正确;
故选D.
11.化肥中的氮肥很多是铵盐.已知氨气通入水中后,其溶液呈碱性.将硫酸铵和氢氧化钙混合后放入试管加热,用湿润的红色石蕊试纸放在试管口,湿润红色石蕊试纸会变蓝色,这是检验铵盐的方法.上述实验现象说明( )
A.铵盐和碱的反应是属于复分解反应类型
B.氨气比空气轻
C.能使红色石蕊试纸变蓝色就是氨气
D.铵盐能和碱反应放出氨气
【解答】解:A、铵盐和碱的反应是属于复分解反应类型,但是不能通过该实验现象证明.故选项错误;
B、氨气比空气轻,但是不能通过该实验现象证明.故选项错误;
C、能使红色石蕊试纸变蓝色的物质不一定是氨气,因为其它显碱性的物质也能使红色石蕊试纸变蓝色.故选项错误;
D、铵盐能和碱反应放出氨气.故选项正确.
故选D.
12.科学实验中,药品和仪器的存放应符合一定的规范.下列物质存放在对应的容器中,符合规范的是( )
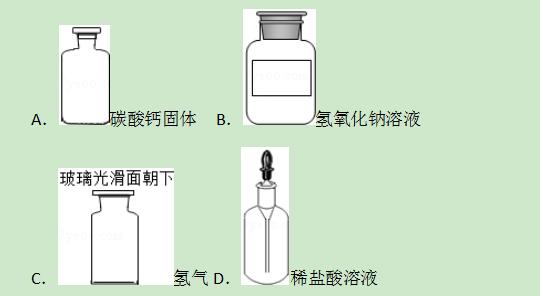
【解答】解:A、碳酸钙固体应放于广口瓶内,故不符合题意;
B、氢氧化钠溶液应放于细口瓶内,故不符合题意;
C、以防氢气漏气,玻璃片磨砂面向下,故不符合题意;
D、稀盐酸可放于滴瓶内,滴管专用,故符合题意.
故选D.
13.“玻璃棒”是化学实验室中经常使用的一种仪器.以下属于玻璃棒用途的是( )
①搅拌 ②引流 ③转移固体 ④蘸取少量溶液.
A.只有①② B.只有①②③ C.只有①②④ D.①②③④
【解答】解:玻璃棒主要用于搅拌、过滤、转移药品等,搅拌时目的可能不同,如能加速溶解,能防止受热不均、能使药品混合均匀等,过滤时引流,可转移液体或固体,有时还用于蘸取少量溶液.
故选:D.
14.下列有关仪器图示与名称吻合的是( )
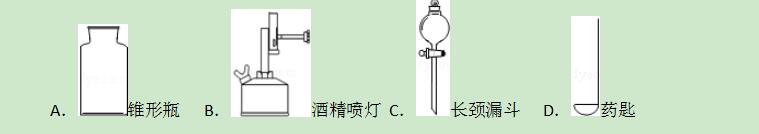
【解答】解:A、图中仪器名称是集气瓶,仪器图示与名称不吻合,故选项错误.
B、图中仪器名称是酒精喷灯,仪器图示与名称吻合,故选项正确.
C、图中仪器名称是分液漏斗,仪器图示与名称不吻合,故选项错误.
D、图中仪器名称是燃烧匙,仪器图示与名称不吻合,故选项错误.
故选:B.
15.逻辑推理是一种重要的化学思维方法,以下推理合理的是( )
A.单质是由一种元素组成的纯净物,所以由一种元素组成的纯净物一定是单质
B.BaCl2与硫酸盐反应生成白色沉淀,所以与BaCl2溶液反应生成白色沉淀的物质一定含有SO42﹣
C.分子都是由原子构成的,所以分子一定都比原子大
D.有机物是含有碳元素的化合物,所以含有碳元素的化合物一定是有机物
【解答】解:A、单质是由一种元素组成的纯净物,由一种元素组成的纯净物,属于单质,故正确.
B、氯化钡能够和硫酸盐反应产生硫酸钡沉淀,但也能和硝酸银溶液反应产生氯化银沉淀,因此不能确定该溶液一定含有硫酸根离子,故错误.
C、分子由原子构成,分子肯定比构成它的原子大,但是,毫无联系的分子和原子没有可比性,如汞原子比氢分子大,故错误;
D、有机物是指含碳元素的化合物,但含碳元素的化合物不一定是有机物,如一氧化碳、二氧化碳等,故错误.
故选:A.
 ,我们将会及时处理。
,我们将会及时处理。