
材料一 实验室里可用固体亚硫酸钠(Na2SO3)和稀硫酸在常温下通过复分解反应(属于固液常温反应),也可采用金属铜与浓硫酸在加热时制得二氧化硫(属于固液加热反应,制得气体较纯)。
材料二 二氧化硫是无色具有刺激性气味的气体,密度比空气大且能溶于水,其水溶液为亚硫酸。亚硫酸不稳定,易分解为二氧化硫和水。二氧化硫能使紫色石蕊试液变红色,也能使高锰酸钾溶液或溴水褪色。二氧化硫通入品红溶液,品红褪色,加热又呈现红色,说明二氧化硫具有漂白性。
根据以上资料和所学的知识,请你回答下列问题:
(1)二氧化硫的物理性质(任答两条)___________、___________。
(2)制取二氧化硫气体所需的发生装置(填字母)___________或___________,收集装置___________。
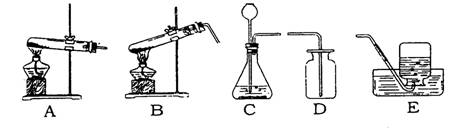
(3)在收集完气体后应将多余的二氧化硫气体通入NaOH溶液(即尾气处理),请你写出这样做的原因___________(用化学方程式表示)。
(4)若在上述实验中气体无法收集满,则可能的原因是___________。
(5)你所学过的知识中,C装置还可以用来做___________ 的实验(举一例即可),写出制取该气体的化学方程式______________________。
(6)某同学错将稀盐酸代替稀硫酸,欲制取纯净、干燥的二氧化硫做性质实验,净化装置中应用 溶液除去盐酸挥发出来的氯化氢气体,干燥装置中应用___________除去水蒸气。
(7)请你对上述实验室制取二氧化硫的两种方法进行评价(写出两点即可)
___________;
___________。
(1) 气体密度比空气大、易溶于水(或有刺激性气味的气体)
(2) C或B;D
(3) SO2+2NaOH=Na2SO3+H2O
(4)装置的气密性不完好
(5)CO2(或H2,或O2) CaCO3+2HCl=CaCl2+H2O+CO2↑(或Zn+H2SO4 =ZnSO4+H2↑,或2H2O22H2O+O2↑)
(6)饱和的亚硫酸氢钠 P2O5固体或浓硫酸
(7)①固液常温反应相对安全,但反应较快,不易控制,且生成的二氧化硫与水反应生成亚硫酸;②固液加热反应相对安全不高,由于有水生成也使硫酸浓度降低而影响反应速率,但因浓硫酸有吸水性使制取的二氧化硫纯度较高。(其它合理答案都对)
某化学活动小组学完酸雨的形成及其危害后,知道二氧化硫是导致酸雨的主要气体之一,对二氧化硫气体产生了浓厚兴趣,对此进行了探究。
[提出问题]
实验室如何制取二氧化硫?能不能像实验室制取二氧化碳那样用CaSO3与酸起反应来制取呢?
[猜想与假设]
猜想①:CaSO3与HCl反应(CaSO3+2HCl=CaCl2+H2O+SO2↑);
猜想②:CaSO3与H2SO4反应(CaSO3+ H2SO4=CaSO4+H2O+SO2↑);
猜想③:Na2SO3与HCl反应(Na2SO3+2HCl=2NaCl+H2O+SO2↑);
猜想④:Na2SO3与H2SO4反应(Na2SO3+ H2SO4=Na2SO4+H2O+SO2↑);
猜想⑤:……
[收集证据]
(一)查阅有关资料:
1.二氧化硫是无色具有刺激性气味的气体,密度比空气大且能溶于水,其水溶液为亚硫酸。亚硫酸不稳定,易分解为二氧化硫和水。二氧化硫能使紫色石蕊试液变红色,能使溴水、高锰酸钾溶液褪色。二氧化硫通入到1%的品红溶液中,品红褪色,加热又呈现红色,说明二氧化硫具有漂白性。
2.学完二氧化碳的知识后已经知道:盐酸特别是浓盐酸具有挥发性,使制得的气体不纯;硫酸钙是微溶的,时间长了会隔绝与酸的接触,阻碍反应的进一步进行。
(二)实验探究:
针对上面的猜想①至猜想④,化学活动小组依次设计了实验方案,进行了实验验证。请你将他们设计的可行的实验探究方案和实验现象,填写在下表中。(已经准备好相应的仪器和药品)
|
猜想 |
可行的实验探究方案 |
观察到的实验现象 |
|
猜想① |
用一支试管取少许CaSO3,加入2ml稀盐酸,将产生的气体通入到澄清石灰水中 |
|
|
猜想② |
|
|
|
猜想③ |
|
|
|
猜想④ |
|
|
[得出结论] _______________________________ 。
[反思与评价]
(1)有同学认为猜想②的验证存在漏洞,你认可(或不认可)的理由是_______________________________ 。
(2)实验室不用猜想①②③制取二氧化硫的原因_______________________________ 。
[交流与应用]
凡事应该一分为二的去看待,二氧化硫有害也有用。你认为二氧化硫在生活中的作用为(写出一条即可)
_______________________________ 。
1.填表:(答案不唯一)
|
猜想 |
可行的实验探究方案 |
观察到的实验现象 |
|
猜想① |
|
产生大量气泡,澄清石灰水变浑浊 |
|
猜想② |
用一支试管取少许CaSO3,加入2ml稀硫酸,将产生的气体通入到紫色石蕊试液中 |
一开始产生气泡,片刻后反应停止,紫色石蕊试液变红色 |
|
猜想③ |
用一支试管取少许Na2SO3,加入2ml稀盐酸,将产生的气体通入到用塑料瓶盛装的NaOH溶液中 |
产生大量气泡,塑料瓶变瘪了 |
|
猜想④ |
用一支试管取少许Na2SO3,加入2ml稀硫酸,将产生的气体通入到1%的品红试液中 |
产生大量气泡,品红试液褪色 |
[得出结论]:
实验室里可采用亚硫酸钠(Na2SO3)固体和稀硫酸在常温下发生反应制得二氧化硫(Na2SO3+H2SO4=Na2SO4+H2O+SO2↑);二氧化硫与二氧化碳具有相似的化学性质,但不完全相同。
[反思与评价]:
(1)认可的理由,使紫色石蕊试液变红色的不一定就是二氧化硫气体,因为二氧化碳气体也有此性质(不认可的理由,猜想中已经说明是CaSO3与H2SO4反应,产生的气体一定是二氧化硫)。
(2)盐酸特别是浓盐酸具有挥发性,使制得的气体不纯;硫酸钙是微溶的,时间长了会隔绝与酸的接触,阻碍反应的进一步进行。
[交流与应用]:
二氧化硫具有漂白作用。生活中常用二氧化硫漂白纸浆、毛、丝、草编制品(如草帽)等(或二氧化硫还能够杀灭霉菌和细菌,可以用作食物和干果的防腐剂)。
 ,我们将会及时处理。
,我们将会及时处理。