
人的胃液中含有盐酸,汽车常用的电瓶(蓄电池)中有硫酸溶液,食醋中含有3%~5%的醋酸,酸雨中含有极少量的硫酸和硝酸。盐酸、硫酸、硝酸、醋酸和碳酸是最常见的几种酸。根据初中化学知识,我们知道酸一般具有以下通性:
①与排在金属活动顺序表H之前的金属反应产生盐和氢气;
②与碱发生中和反应生成盐和水;
③与碳酸钙、碳酸钠反应产生二氧化碳、水和新盐;
④与金属氧化物反应生成盐和水;
⑤能使酸碱指示剂变色。
[试一试] 1.以稀硫酸为例,各举一例化学反应方程式说明其一般性质。
氢氧化钠俗称烧碱、火碱或苛性钠,氢氧化钙俗称消石灰或熟石灰,NH3·H2O是NH3的水溶液,即氨水,它们都是常见的碱。根据初中化学知识,我们知道碱一般具有以下通性:
①与酸发生中和反应生成盐和水;
②与CO2反应生成盐和水;
③与CuCl2等盐反应生成新盐和新碱;
④能使酸碱指示剂变色。
[试一试] 2.以氢氧化钙为例,各举一例化学反应方程式说明其一般性质。
盐是我们每天都离不开的调味品,生活中的盐是指食盐,也就是氯化钠,化学学科中的盐是指由碱的阳离子和酸的阴离子组成的化合物。我们在生产、生活中经常用到各种各样的盐,如食盐、碳酸钙(大理石)、硫酸铝、碳酸氢钠(小苏打)、硫酸铵、碳酸氢铵等等。一般来说,盐可以和酸、碱、其他盐发生化学反应,不同组成的盐性质各不相同。
二氧化碳、氧化镁、四氧化三铁等是由两种元素组成的化合物,其中一种元素是氧,这样的化合物叫做氧化物。不同的氧化物性质各不相同,如CuO能和酸反应,CO2既能和碱反应又能和水反应。
图书馆里有许许多多的书籍,为什么你能够很快就找到你所需要的图书?大型超市里有成千上万种商品,为什么你能够迅速挑出你所需要的商品?这是因为人们在将这些书籍或商品陈列到书架或货架之前,已经事先对它们进行了分类处理。把大量事物按照事先设定的“标准”进行分类,是人们最熟悉,也是最方便的一种工作方法,这种方法在社会生活、经营管理和科学技术中得到了广泛的应用。
经过收集例证和思索,我们可以发现分类法应用的普遍性。当分类的标准确定之后,同类中的事物在某些方面的相似性可以帮助我们做到举一反三;对于不同类事物的了解使我们做到由此及彼。所以分类法是一种行之有效,简单易行的科学方法。生物学中把动植物按照界、门、纲、目、科、属、种进行分类的方法是最有代表性的实例之一,对生物学的发展起到重要作用。
对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的。例如,在初中化学中,我们曾经把元素分为金属元素和非金属元素,把化合物分为酸、碱、盐和氧化物,把化学反应分为化合反应、分解反应、置换反应和复分解反应等等。
由于一种分类方法所依据的标准有一定局限,所能提供的信息较少,人们在认识事物时往往需要采用多种分类方法(如交叉分类法),来弥补单一分类方法的不足,例如,对于Na2CO3,从其组成的阳离子来看,属于钠盐;而从其组成的阴离子来看,则属于碳酸盐。
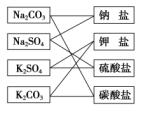
有时,物质或反应进行一次分类所产生的结果,相似性还不够明显,这时我们可以对其中的每一类物质或反应进行再分类,形成更科学的认识。化学上,通常可根据物质的组成、状态、性质等对物质进行分类。例如:根据物质的存在状态,将物质分为气态物质、液态物质和固态物质;根据物质的导电性,将物质分为导体、半导体和绝缘体;根据物质在水中的溶解性,将物质分为可溶性物质、微溶性物质和难溶性物质。从学习物质化学性质的需要出发,我们更喜欢根据物质的组成和性质特点,对物质进行分类。根据组成物质所含分子种类,可以将物质分成纯净物和混合物;再根据组成元素的种类,又可将纯净物分成单质和化合物;根据组成元素的种类不同,还可将单质分成金属单质和非金属单质;根据是否含有碳元素又可将化合物分成有机化合物和无机化合物……理论上,我们可以不断地对所得分类结果进行再分类,这种分类关系一般可用树状图进行表示,所以这种分类方法又称为“树状分类法”(下图为化学上对物质的常见树状分类)。
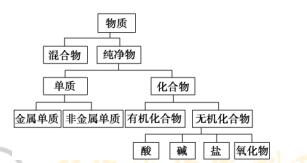
[试一试] 3.用树状图表示下列物质的分类:镁(Mg)、 氯气(Cl2)、氯化铁(FeCl3)溶液、硫酸(H2SO4)、硝酸钡[Ba(NO3)2]、三氧化二铁(Fe2O3)、 氢氧化钠(NaOH)、葡萄糖(C6H12O6)、 乙醇(C2H5OH)、碘酒、二氧化碳。
资料卡片 在无机酸分子中,一般分子中有几个氢就是几元酸,但我们不能简单根据有机酸分子中H个数确定它是几元酸,如醋酸(CH3COOH)有4个H,但它是一元酸。
在水溶液中产生的阳离子全部是氢离子的化合物称之为酸。盐酸、硫酸、硝酸、碳酸和醋酸是几种最常见的酸。人们还可以根据它们在组成、性质上的差异,进行更为细致的划分。如根据组成中是否含氧元素可以分为含氧酸和无氧酸,硫酸、硝酸、碳酸和醋酸就是常见的含氧酸,而盐酸则是无氧酸;根据酸产生氢离子的程度可以分为强酸和弱酸,如盐酸、硫酸、硝酸是强酸,而碳酸、醋酸是弱酸;根据每个酸分子电离产生的氢离子个数可以分为一元酸、二元酸、三元酸,如盐酸、硝酸是一元酸,硫酸、碳酸是二元酸,磷酸(H3PO4)是三元酸;根据酸是否具有挥发性,可以分成难挥发性酸和挥发性酸,硫酸和磷酸是难挥发性酸,盐酸、硝酸、醋酸都是挥发性酸;还可以根据在有机化合物和无机化合物中的归属,将酸分为无机酸和有机酸,醋酸是最常见的有机酸,其他一般都是无机酸。
资料卡片 严格意义上说,盐酸、氨水是混合物,不能称之为酸、碱,而应该称HCl、NH3·H2O为酸、碱,只是人们一直沿用习惯了,学习中要注意这一习惯。
在水溶液中产生的阴离子全部是氢氧根离子的化合物称之为碱,氢氧化钠、氢氧化钙、氢氧化铜是几种重要的碱。对碱进行再分类,将更加有利于我们理解碱的化学性质。一般可根据碱产生氢氧根离子的难易程度分为强碱和弱碱,氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡[Ba(OH)2]是常见的强碱,而氢氧化铁、氢氧化铜、NH3·H2O是常见的弱碱;根据溶解性差异可分为可溶性碱、微溶性碱和难溶性碱,氢氧化钠、氢氧化钾、氢氧化钡、NH3·H2O是可溶性碱,氢氧化钙是微溶性碱,氢氧化铁、氢氧化铜是难溶性碱。可溶性或微溶性碱一般是强碱,可以由对应的金属氧化物和水化合而成,在加热条件下不易分解;而难溶性碱一般是弱碱,在加热条件下可以分解成对应金属氧化物和水,但不能由对应金属氧化物和水化合而成。
[想一想] 能否通过一步反应完成下列转变:Fe2O3→Fe(OH)3和K2O→KOH。
由金属阳离子(或铵根)与酸根离子构成的化合物称之为盐。碳酸钙、氯化钠、硫酸铜都是重要的盐。对盐的进一步分类,有利于我们更好的学习盐的化学性质。盐可以依据组成分为钠盐、钾盐、钙盐等,也可以分为盐酸盐、硫酸盐、硝酸盐、碳酸盐等;根据在水中的溶解性分为可溶性盐、微溶性盐和难溶性盐。依据所含的金属阳离子的密度大小,又可以分为轻金属盐和重金属盐,BaCl2、CuSO4、FeCl3属于重金属盐;还可以根据盐能否产生H+或OH-,把盐分为酸式盐和碱式盐,NaHCO3、NaHSO4是常见的酸式盐,Cu2(OH)2CO3是常见的碱式盐,对于NaCl、CuSO4等既没有H+也没有OH-,它们被称为正盐,初中化学学习的盐大部分都是这种正盐。
[试一试] 4.Mg(OH)Cl属于盐还是碱?如果是盐它又能归属于哪些类型。
资料卡片 水体重金属离子污染,是指含有重金属离子的污染物进入水体对水体造成的污染。冶矿、机械制造、化工、电子、仪表等工业生产过程中产生的重金属废水(含有铬、镉、铜、汞、镍等重金属离子),是对水体污染最严重和对人类危害最大的工业废水之一。废水中的重金属离子是各种常用水处理方法不能分解破坏的,而只能转移它们的存在位置和转变它们的物理化学状态。因此,重金属废水应当在产生地点就地处理,不与其他废水混合。如果用含有重金属离子的污泥和废水作为肥料和灌溉农田,会使土壤受到污染,造成农作物及水生生物重金属离子的富集,通过食物链最终对人体产生严重危害。
镉污染:自1995年起,居住在日本富山市神通川下游地区的一些农民得了一种奇怪的病。得病初期,患者只感到腰、背和手足等多处关节疼痛,后来发展为神经痛。患者走起路来像鸭子一样摇摇摆摆,晚上睡在床上经常痛得直喊“痛……”因此这种病被称为“痛痛病”,又称为“骨痛病”。得了这种病,人的身高缩短,骨骼变形、易折,轻微活动,甚至咳嗽一声,都可能导致骨折,一些人痛不欲生,自杀身亡。经过调查,造成这种”骨痛病“的原因是神通川上游的炼锌厂长年累月排放含镉的废水,当地农民长期饮用受到镉污染的河水,并且食用此河水灌溉生长的稻米,于是镉便通过食物链进入人体,在体内逐渐积聚,引起镉中毒,造成“骨痛病”。
汞污染:五十年代初期,在日本九州熊本县水俣镇,由于人食用受甲基汞毒害的鱼类而导致甲基汞中毒,283人中毒,其中60人死亡。症状:口齿不清、步履不稳、面部痴呆进而耳聋眼瞎、全身麻木,最后精神失常,身体弯曲至死亡。产生原因是由于工厂生产氯乙烯和醋酸乙烯时采用氯化汞和硫酸作催化剂,最后把含有机汞的废水、废渣排入水俣湾,使鱼、贝壳类受到污染,这起事件被史学家称为“水俣事件”。
锰污染:四十多年前,日本有个村庄发生了一起可怕的集体“发疯”事件,有16个村民突然一起“发疯”了。这些“疯子”一会儿哭哭啼啼,一会儿又哈哈大笑;发作时两手乱摇,颤抖不止,且下肢发硬僵直,如此反复发作,直至“疯死”。调查发现这些人喝的是同一口水井中的水,考察水井,又在旁边挖出了大量废旧、破烂的干电池。原来这是水井受干电池中某些有害成分污染而造成的。据环境科学家研究表明,废旧干电池中的锌、二氧化锰等成分长期埋在地下,会与土壤中化学物质发生作用,生成锌锰酸式盐,它渗入地下,极易污染饮用水,而这一群村民正是长期饮用这种水,造成蓄积性锰中毒,才有上述“发疯”症状。
干电池在制造过程中还使用一定量的汞,含汞最多的是锌汞电池,高达20% ~30%,碱性干电池约为13%,普通锌锰电池含汞较少。因此干电池不仅是锰污染源,同时还是汞污染源,在享受干电池给我们生活带来便利的同时,必须关注废旧电池对环境的危害,采取切实有效的回收方法,以减轻电池对环境的危害。据统计,我国每年生产干电池50亿只,其中锌汞电池和碱性电池1亿只,每年电池用汞100吨,人们习惯用完电池后随意乱丢,日晒雨淋或埋入地下往往污染环境,废旧电池回收是目前我们必须解决的一个重要环境问题。
二氧化碳、一氧化碳、水、氧化铜、氧化钙、氧化镁、四氧化三铁等都是常见的氧化物,不同氧化物性质既有相同点,也有不同点,对氧化物进一步分类,有助于找出各类物质的基本通性。一般氧化物可以按组成分为金属氧化物和非金属氧化物,如CO、CO2、SiO2就是非金属氧化物,Mn2O7、CuO、Fe2O3就是金属氧化物。另一种常用方法是根据氧化物能否和酸、碱反应生成盐和水,将其分成不成盐氧化物和成盐氧化物,如CO、NO为不成盐氧化物,而CO2、SiO2、CuO、Fe2O3为成盐氧化物。根据成盐氧化物和酸、碱反应的可能性又可分成不同类型,与碱反应生成盐和水的氧化物称为酸性氧化物,如CO2、SiO2;与酸反应生成盐和水的氧化物称为碱性氧化物,如CaO、Na2O。
CO2+Ca(OH)2===CaCO3↓+H2O
Mn2O7+2KOH===2KMnO4+H2O
CaO+2HCl===CaCl2+H2O
CuO+H2SO4===CuSO4+H2O
[试一试] 5.不同分类结果之间的归属关系,是氧化物概念的考查重点,那么金属氧化物一定是碱性氧化物吗?酸性氧化物一定是非金属氧化物吗?
事实上,有些氧化物不但可以和酸反应生成盐和水,也可以和碱反应生成盐和水,这种氧化物就被称为两性氧化物,氧化铝是其中的典型代表。
Al2O3+6HCl===2AlCl3+3H2O
Al2O3+2NaOH===2NaAlO2+H2O(NaAlO2称为偏铝酸钠)
 ,我们将会及时处理。
,我们将会及时处理。