三、燃烧热、中和热
1.燃烧热
(1)概念:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。
注意:完全燃烧,是指物质中下列元素完全转变成对应的物质:C→C02,H→H20,S→S02等。
(2)表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
2.中和热 (1)概念:在稀溶液中,酸跟碱发生中和反应而生成 1 molH20,这时的反应热叫中和热。
(2)中和热的表示:H+(aq)+OH-(aq)=H2O (1); △H=-57.3kJ/mol。
3.使用化石燃料的利弊及新能源的开发
(1)重要的化石燃料:煤、石油、天然气
(2)煤作燃料的利弊问题
①煤是重要的化工原料,把煤作燃料简单烧掉太可惜,应该综合利用。
②煤直接燃烧时产生S02等有毒气体和烟尘,对环境造成严重污染。
③煤作为固体燃料,燃烧反应速率小,热利用效率低,且运输不方便。
④可以通过清洁煤技术,如煤的液化和气化,以及实行烟气净化脱硫等,大大减少燃煤对环境造成的污染,提高煤燃烧的热利用率。
(3)新能源的开发
①调整和优化能源结构,降低燃煤在能源结构中的比率,节约油气资源,加强科技投入,加快开发水电、核电和新能源等就显得尤为重要和迫切。
②最有希望的新能源是太阳能、燃料电池、风能和氢能等。这些新能源的特点是资源丰富,且有些可以再生,为再生性能源,对环境没有污染或污染少。
理解中和热时注意:
①稀溶液是指溶于大量水的离子。②中和热不包括离子在水溶液中的生成热、电解质电离的吸热所伴随的热效应。③中和反应的实质是H+和OH-化合生成 H20,若反应过程中有其他物质生成,这部分反应热也不在中和热内。
四、中和热测定实验
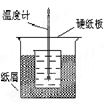
在50 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在下图装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题。
(1)大小烧杯间填满碎纸条的作用是什么?
(2)大烧杯上如不盖硬纸板,对求得中和热的数值有何影响?
(3)改用60 mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量是否相等?所求中和热数值是否相等?简述理由。
(4)用相同浓度和体积的氨水代替氢氧化钠溶液进行上述实验,为什么测得中和热的数值偏低?
五、反应焓变的计算
1. 盖斯定律:对于一个化学反应,无论是一步完成还是分几步完成,其反应焓(热量)变是一样的。
2. 据盖斯定律计算化学反应的焓变
进行反应的焓变计算应注意的问题
(1) 由于△H与反应物的物质的量有关,因此热化学方程式中化学式前面的化学计量数必须与△H相对应。如化学计量数成倍减少或增加,则△H也要成倍的减少或成倍的增加。当反应向逆向进行时,其反应热与正反应的反应热数值相等,正负号相反。
(2) 在使用盖斯定律时,伴随着两个或多个方程式的加减处理时,△H的计算一定要带上正负号。
- 2017-08-13教师招聘考试化学学科考点:化学能与热能经典题(二)
- 2017-08-13教师招聘考试化学学科考点:化学能与热能经典题(一)
- 2017-07-31教师招聘考试化学学科高频考点:化学能与热能汇总
- 2017-07-31教师招聘考试化学学科高频考点:化学能与热能(八)
- 2017-07-31教师招聘考试化学学科高频考点:化学能与热能(七)
-
12017-07-31教师招聘考试化学学科高频考点:化学能与热能汇总
-
22017-07-31教师招聘考试化学学科备考之氧化还原反应汇总
-
32017-06-012017教师招聘考试化学能与电能
