1.(RJ选修4·P59改编题)下列反应既不是水解反应,又不是氧化还原反应的是 ( )
A.N +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
B.HS-+H2O H2S+OH-
H2S+OH-
C.Br2+H2O HBr+HBrO
HBr+HBrO
D.H2S+H2O H3O++HS-
H3O++HS-
【解析】选D。A项为N 的水解反应;B项是HS-的水解反应;C项是Br2与水的反应,属于氧化还原反应;D项为H2S的电离。
的水解反应;B项是HS-的水解反应;C项是Br2与水的反应,属于氧化还原反应;D项为H2S的电离。
2.(RJ选修4·P59改编题)常温下,0.1 mol·L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列判断中正确的是( )
A.HX、HY、HZ的酸性依次增强
B.离子浓度:c(Z-)>c(Y-)>c(X-)
C.电离常数:K(HZ)>K(HY)
D.c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ)
【解析】选D。NaX、NaY、NaZ的pH分别为7、8、9,则HX是强酸,HY、HZ是弱酸,再根据水解规律可知HY的酸性强于HZ的酸性。所以酸性:HX>HY>HZ,故A、C错误。根据“越弱越水解”可知B错误。D选项是正确的物料守恒关系式。
3.(RJ选修4·P59改编题)把0.02 mol·L-1CH3COOH溶液与0.01 mol·L-1NaOH溶液等体积混合,则混合液中微粒浓度关系正确的是( )
A.c(CH3COO-)>c(Na+)
B.c(CH3COOH)>c(CH3COO-)
C.2c(H+)=c(CH3COO-)-c(CH3COOH)
D.c(CH3COOH)+c(CH3COO-)<0.01 mol·L-1
【解析】选A。CH3COOH溶液与NaOH溶液混合后,发生反应:CH3COOH+NaOH CH3COONa+H2O,并且生成的CH3COONa和剩余的CH3COOH浓度相等。若不考虑CH3COOH的电离和CH3COO-的水解,则c(CH3COOH)=c(Na+)=c(CH3COO-),但由于CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Na+)> c(CH3COOH),即A项正确,B项不正确。根据碳原子守恒,可知D项不正确。C项不符合任何一个守恒,也不能由三个守恒推导得出,是错误的。
CH3COONa+H2O,并且生成的CH3COONa和剩余的CH3COOH浓度相等。若不考虑CH3COOH的电离和CH3COO-的水解,则c(CH3COOH)=c(Na+)=c(CH3COO-),但由于CH3COOH的电离程度大于CH3COO-的水解程度,所以c(CH3COO-)>c(Na+)> c(CH3COOH),即A项正确,B项不正确。根据碳原子守恒,可知D项不正确。C项不符合任何一个守恒,也不能由三个守恒推导得出,是错误的。
4.(SJ选修4·P85改编题)现有浓度为0.1 mol·L-1的五种电解质溶液
①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH
这五种溶液的pH由小到大的顺序是( )
A.⑤③①②④ B.①④②③⑤
C.④②①③⑤ D.②④①③⑤
【解析】选C。五种溶液均呈碱性,由于酸性:CH3COOH>H2CO3>HC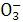 >Al(OH)3,故根据越弱越水解的规律,pH由小到大的顺序为④②①③⑤。
>Al(OH)3,故根据越弱越水解的规律,pH由小到大的顺序为④②①③⑤。
【模拟预测强化练】
1.(2016·梅州模拟)常温下,下列说法错误的是( )
A.pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(S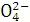 )+c(OH-)
)+c(OH-)
B.0.1 mol·L-1NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变
C.pH相同的①CH3COONa、②NaClO两种溶液的c(Na+):①>②
D.0.1 mol·L-1Na2SO3溶液:c(Na+)=2c(S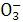 )+c(HS
)+c(HS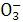 )+c(H2SO3)
)+c(H2SO3)
【解析】选D。c(Na+)+c(H+)=2c(S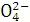 )+c(OH-)是电荷守恒,A对,不选;水的离子积只与温度有关,温度不变,水的离子积不变,B对,不选;CH3COO-的水解程度比ClO-小,所以pH相同的CH3COONa、NaClO两种溶液,CH3COONa的浓度要大,故c(Na+):①>②,C对,不选;Na2SO3溶液的物料守恒应该是c(Na+)=2c(S
)+c(OH-)是电荷守恒,A对,不选;水的离子积只与温度有关,温度不变,水的离子积不变,B对,不选;CH3COO-的水解程度比ClO-小,所以pH相同的CH3COONa、NaClO两种溶液,CH3COONa的浓度要大,故c(Na+):①>②,C对,不选;Na2SO3溶液的物料守恒应该是c(Na+)=2c(S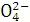 ) +2c(HS
) +2c(HS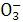 )+2c(H2SO3),D错。
)+2c(H2SO3),D错。
2.(2016·雅安模拟)为了配制N 浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl固体③适量的氨水④适量的NaOH固体,正确的是( )
浓度与Cl-的浓度比为1∶1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl固体③适量的氨水④适量的NaOH固体,正确的是( )
A.①② B.③ C.③④ D.④
【解析】选B。在NH4Cl溶液中存在水解平衡:N+H2O
 NH3·H2O+H+,因此NH4Cl溶液中c(N
NH3·H2O+H+,因此NH4Cl溶液中c(N )∶c(Cl-)<1∶1,要使c(N
)∶c(Cl-)<1∶1,要使c(N )∶c(Cl-)=1∶1,则需增大c(N
)∶c(Cl-)=1∶1,则需增大c(N )或减小c(Cl-)。①加入适量的HCl,平衡逆向移动,使c(N
)或减小c(Cl-)。①加入适量的HCl,平衡逆向移动,使c(N )增大,但是平衡移动增加的量很小,c(Cl-)增大的多,因此N浓度与Cl-的浓度比反而减小,错误。②加入适量的NaCl固体,c(N
)增大,但是平衡移动增加的量很小,c(Cl-)增大的多,因此N浓度与Cl-的浓度比反而减小,错误。②加入适量的NaCl固体,c(N )不变,c(Cl-)增大,c(N
)不变,c(Cl-)增大,c(N )∶c(Cl-)减小,错误。③加入适量的氨水,c(NH3·H2O)增大,使N
)∶c(Cl-)减小,错误。③加入适量的氨水,c(NH3·H2O)增大,使N 的水解平衡逆向移动,会使c(N
的水解平衡逆向移动,会使c(N )增大,而c(Cl-)减小,因此c(N
)增大,而c(Cl-)减小,因此c(N )∶c(Cl-)增大,更接近 1∶1,正确;④加入适量的NaOH固体,消耗H+,c(H+)减小,使平衡正向移动,c(N
)∶c(Cl-)增大,更接近 1∶1,正确;④加入适量的NaOH固体,消耗H+,c(H+)减小,使平衡正向移动,c(N )减小,c(Cl-)不变,c(N
)减小,c(Cl-)不变,c(N )∶c(Cl-)减小,错误。
)∶c(Cl-)减小,错误。
3.(2016·武昌模拟)在一定条件下,Na2CO3溶液中存在C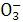 +H2O
+H2O HC
HC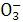 +OH-平衡。下列说法不正确的是( )
+OH-平衡。下列说法不正确的是( )
A.稀释溶液: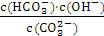
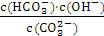 增大
增大
B.通入CO2,溶液pH减小
C.升高温度,平衡常数增大
D.加入NaOH固体,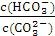
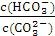 减小
减小
【解析】选A。由平衡常数表达式可得K=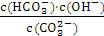
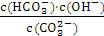 ,K只随温度的变化而变化,所以稀释后达平衡,此值不变,故A错;B选项中通入CO2,会使溶液中OH-浓度减小,所以溶液的pH也减小;C选项中升高温度平衡向吸热方向移动,而盐的水解吸热,所以平衡常数增大;D中加入OH-时抑制C
,K只随温度的变化而变化,所以稀释后达平衡,此值不变,故A错;B选项中通入CO2,会使溶液中OH-浓度减小,所以溶液的pH也减小;C选项中升高温度平衡向吸热方向移动,而盐的水解吸热,所以平衡常数增大;D中加入OH-时抑制C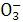 水解,所以C
水解,所以C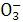 浓度增大,而HC
浓度增大,而HC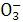 浓度减小,所以
浓度减小,所以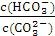
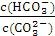 减小。
减小。
4.(2016·泉州模拟)在0.1 mol·L-1的醋酸钠溶液中加入等体积的下列物质,溶液中离子浓度大小关系正确的是( )
A.水;c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
B.0.1 mol·L-1盐酸;c(Na+)=c(Cl-)>c(H+)>c(CH3COO-)>c(OH-)
C.0.1 mol·L-1醋酸;c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
D.0.1 mol·L-1氢氧化钠;c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
【解析】选B。A项,正确的离子浓度顺序为c(Na+)>c(CH3COO-)>c(OH-)>c(H+);B项,加入0.1 mol·L-1盐酸后,生成等浓度的NaCl和醋酸混合液,故有c(Na+)=c(Cl-),考虑水的电离,故有c(H+)>c(CH3COO-),B正确;C项,电离大于水解,正确的离子浓度顺序为c(CH3COO-)>c(Na+)>c(H+)>c(OH-);D项,正确的离子浓度顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+)。
5.(2016·绵阳模拟)对下列电解质溶液的叙述错误的是( )
A.等物质的量浓度的Na2CO3和NaHCO3混合液中:c(Na+)>c(HC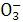 )>c(C
)>c(C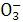 )> c(OH-)>c(H+)
)> c(OH-)>c(H+)
B.25℃时0.2 mol·L-1盐酸与等体积0. 05 mol·L-1Ba(OH)2溶液混合后,溶液的pH=1
C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+)
D.25℃时,若0.3 mol·L-1HY溶液与0.3 mol·L-1NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=1×10-9mol·L-1
【解析】选B。A.等物质的量浓度的Na2CO3和NaHCO3混合液中碳酸根的水解程度大于碳酸氢根,则溶液中:c(Na+)>c(HC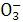 )>c(C
)>c(C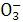 )>c(OH-)>c(H+),A正确; B.25℃时0.2 mol·L-1盐酸与等体积0. 05 mol·L-1Ba(OH)2溶液混合后盐酸过量,则反应后溶液中氢离子浓度=
)>c(OH-)>c(H+),A正确; B.25℃时0.2 mol·L-1盐酸与等体积0. 05 mol·L-1Ba(OH)2溶液混合后盐酸过量,则反应后溶液中氢离子浓度=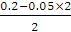
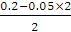 =0.05 mol·L-1,则溶液的pH不是1,B错误;C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,即c(OH-)=c(H+)。又根据电荷守恒可知2c(R2-)+c(HR-)+c(OH-)= c(H+)+c(Na+),所以反应后的混合液中:2c(R2-)+c(HR-)=c(Na+),C正确;D.
=0.05 mol·L-1,则溶液的pH不是1,B错误;C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,即c(OH-)=c(H+)。又根据电荷守恒可知2c(R2-)+c(HR-)+c(OH-)= c(H+)+c(Na+),所以反应后的混合液中:2c(R2-)+c(HR-)=c(Na+),C正确;D.
25℃时,若0.3 mol·L-1HY溶液与0.3 mol·L-1NaOH溶液等体积混合后,溶液的pH=9,说明酸根水解,溶液显碱性,则根据质子守恒可知c(OH-)=c(HY)+c(H+)故c(OH-)-c(HY)=c(H+)=1×10-9mol·L-1,D正确。
6.常温下有浓度均为0.5 mol·L-1的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液
③HCl溶液 ④氨水
(1)上述溶液中,可发生水解的是________(填序号,下同)。
(2)上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为 __。
(3)向④中加入少量氯化铵固体,此时溶液中c(N )/c(OH-)的值________(填“增大”“减小”或“不变”)。
)/c(OH-)的值________(填“增大”“减小”或“不变”)。
(4)若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积________④的体积(填“大于”“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是 __。
(5)取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=____________。
【解析】(2)既能与氢氧化钠反应,又能和硫酸反应的物质是NaHCO3,NaHCO3是强碱弱酸盐,在水中HC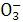 既可以水解,又可以电离,但水解程度大于电离程度,水溶液显碱性,故溶液中的离子浓度大小的顺序为c (Na+)>c(HC
既可以水解,又可以电离,但水解程度大于电离程度,水溶液显碱性,故溶液中的离子浓度大小的顺序为c (Na+)>c(HC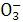 )>c(OH-)> c(H+)>c(C
)>c(OH-)> c(H+)>c(C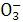 )。(3)因④中存在NH3·H2O
)。(3)因④中存在NH3·H2O N
N +OH-,加入NH4Cl后导致c(N
+OH-,加入NH4Cl后导致c(N )增大,c(OH-)减小,故c(N
)增大,c(OH-)减小,故c(N )/c(OH-)的值增大。(4)若盐酸与氨水等体积混合,溶液恰好反应完全,溶液呈酸性,现在溶液呈中性,意味着酸的量不足,盐酸体积小于氨水体积,由电荷守恒原理知此时c(N
)/c(OH-)的值增大。(4)若盐酸与氨水等体积混合,溶液恰好反应完全,溶液呈酸性,现在溶液呈中性,意味着酸的量不足,盐酸体积小于氨水体积,由电荷守恒原理知此时c(N )=c(Cl-)。(5)稀释后c(HCl)=0.01 mol·L-1,则c(OH-)=10-12mol·L-1,故由水电离出的c(H+)=10-12mol·L-1。
)=c(Cl-)。(5)稀释后c(HCl)=0.01 mol·L-1,则c(OH-)=10-12mol·L-1,故由水电离出的c(H+)=10-12mol·L-1。
答案:(1)①②
(2)c(Na+)>c(HC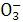 )>c(OH-)>c(H+)>c(C
)>c(OH-)>c(H+)>c(C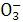 )
)
(3)增大
(4)小于 c(N )=c(Cl-)>c(H+)=c(OH-)
)=c(Cl-)>c(H+)=c(OH-)
(5)10-12mol·L-1